作者:Paul Smolen, Yili Zhang 和 John H. Byrne
摘要
对于多种学习类型而言,采用较长间隔并重复进行的间隔式训练,比采用短间隔或无间隔的集中式训练能形成更为牢固的记忆。为解释这种优势,研究者提出了多种认知理论,但直到近期,揭示间隔训练背后细胞和分子机制的数据才开始涌现,本文将对这些理论和数据进行综述。对相关信号传导通路的计算模型研究预测,采用不规则间隔时间的间隔训练可以进一步增强学习效果。这种利用模型预测最佳间隔训练方案的策略,结合药物治疗,为修复受损的突触可塑性和改善学习能力提供了全新途径。
重复训练有助于形成长期记忆。将训练课程安排在较长时间间隔内的学习方式被称为间隔训练或间隔学习。自从 Ebbinghaus 的开创性研究以来,人们已知这种训练方式在促进记忆形成方面优于短间隔的训练(集中训练或集中学习)。Ebbinghaus 指出:「对于大量的重复练习,将它们适当分散在一段时间内,明显比将它们集中在同一时间点进行更为有利」。他的研究基于对自学音节列表记忆的自我测试,但间隔训练的优势现已在人类学习的众多其他形式中得到证实。例如,间隔学习比集中学习在记忆事实、概念和列表
、技能学习和运动学习
、课堂教育(包括科学学习和词汇学习)
以及儿童概念知识泛化
方面更为有效。间隔训练也能提高无脊椎动物的记忆能力,如软体动物加尼福尼亚海兔
、果蝇
和蜜蜂
,以及啮齿类动物
和非人类灵长类动物
。记忆消退通常被认为涉及形成新的记忆,在大鼠恐惧条件作用研究中,相较于集中性消退试验,间隔性消退试验在建立新记忆方面更为有效
。
记忆消退
当先前与条件刺激反复配对的强化刺激被撤除后,已学习的对条件刺激的行为反应逐渐减弱的过程。
尽管研究已经证实间隔训练在促进记忆形成方面优于集中训练,但仍有几个关键问题有待解答。这种优势背后的机制究竟是什么?我们能否利用这些机制信息来确定学习试验之间的最佳间隔时间?如果可以,那么固定间隔、递增间隔或不规则间隔哪一种效果最佳?另一个关键问题是,对这些最佳间隔机制的理解能否为开发增强记忆的药理学方法提供启示?基于这种机制性理解的计算模型可能有助于预测更复杂的记忆改善策略,例如多种药物的联合应用,或药物与训练方案的结合,从而增强记忆或治疗学习和记忆障碍。
在本综述中,我们将阐述分子研究的新见解如何有助于解释间隔训练的有效性,以及这些分子发现与试图解释这种有效性的传统学习理论之间的关联。我们还将回顾参与突触可塑性的信号通路模型如何提出——并通过实验验证——改善学习效果的训练方案,以及如何挽救因关键分子成分缺失而受损的可塑性。最后,我们将讨论近期提出的模型,这些模型提出组合药物疗法可能进一步增强某些形式的学习,并可能与优化的间隔学习在记忆形成方面产生协同作用。
传统学习理论
我们将简要总结三种著名的认知理论,这些理论试图解释间隔训练优于集中训练的原因:编码变异性理论、学习阶段提取理论和加工不足理论。
编码可变性理论提出,当重复呈现刺激或学习试次在时间上间隔较长时,它们更可能发生在多种不同的情境中,因此对这些重复试次形成的记忆痕迹会包含各种情境的元素。这样,间隔训练倾向于将更多情境信息整合在一起,从而形成更为牢固的记忆,因为更多样化的测试情境都能触发该记忆的提取。
学习阶段提取理论认为,间隔式的刺激呈现或学习试次之所以比密集式试次更有效地强化记忆,是因为每次间隔试次都能引发对前一次试次形成的记忆痕迹的提取和重新激活。相比之下,在短时间内密集进行的试次中,前一个记忆痕迹仍处于活跃状态,因此不会被提取或重新激活,也就无法强化记忆。学习阶段提取理论还解释了为什么间隔过长的试次会导致学习效果下降——在这种情况下,先前形成的记忆痕迹已无法被提取。最近发展出的一种变体——提取情境理论,整合了编码可变性理论的一些元素,并成功预测了随后在人类中进行的间隔学习实验结果
。
加工不足理论认为,间隔训练比集中训练能形成更强的记忆,这是因为在集中训练中,某些形成记忆所必需的过程未能得到有效执行。通过考察阐明加工不足本质的各种理论变体,这一推理变得更加清晰。其中一种变体认为,集中试验期间的过度习惯化阻碍了记忆痕迹的有效强化;而其他变体则提出可能存在记忆巩固失败(即巩固理论
,对集中呈现的内容缺乏主动注意力
,或在集中训练特有的短时间间隔内缺少认知排练或记忆再激活
。
强化
这里作为广义术语使用,描述能够增强记忆强度或延长记忆持续时间的刺激或项目。
记忆再激活
指条件性行为反应或与特定反应相关的神经活动的重新激活,可通过呈现条件刺激或先前学习发生的环境来触发,也可以是自发的,作为正常持续神经活动的一部分出现。
习惯化
指在频繁重复某一刺激后,对该刺激的行为反应减弱;这一术语与消退不同,因为习惯化可以指对从未与强化刺激配对的刺激的反应减弱。
记忆巩固是指记忆痕迹在学习训练后随着时间的推移变得更加固定和稳定的过程。因此,巩固理论
认为,通过间隔学习可以更有效地稳定或增强长期记忆痕迹。加工不足理论中关于「缺乏认知排练」的变体也可以被视为巩固理论的一种更具体的形式,因为它假定记忆痕迹的巩固需要最低数量的排练或自发性再激活。加工不足理论的各种变体及相关实验在参考文献 28、40、41 中有更详细的讨论。接下来,我们将主要关注巩固理论,因为在所有传统学习理论中,它与我们目前对记忆的细胞和分子机制的理解最为契合。
Landauer 是最早构建概念模型来阐释间隔原理如何解释间隔训练有效性的研究者之一。尽管该模型最初旨在解释短时间间隔对记忆形成的影响,但它可以轻松扩展应用于任意长度的间隔(图 1)。此模型基于两个基本假设。第一,神经回路在首次学习尝试后处于这样一种状态:短时间内进行的第二次强化尝试不会显著增强第一次尝试形成的学习痕迹的巩固过程(图 1a)。因此,在集中训练中,痕迹之间的重叠可能导致某种尚未明确定义的分子机制饱和,从而削弱了这些痕迹对记忆巩固的综合影响。只有当第一次尝试的效应逐渐减弱后,第二次尝试的效应才能充分表现出来(图 1b,c),这使得间隔训练比集中训练在记忆巩固方面具有更大潜力(净收益更高;参见图 1d)。第二个假设是,第二次尝试成功强化第一次尝试的概率会随时间推移而降低(图 1e)。实际的巩固效果是这两个假设的乘积,由此预测出了间隔学习的最佳时间间隔(图 1f)。
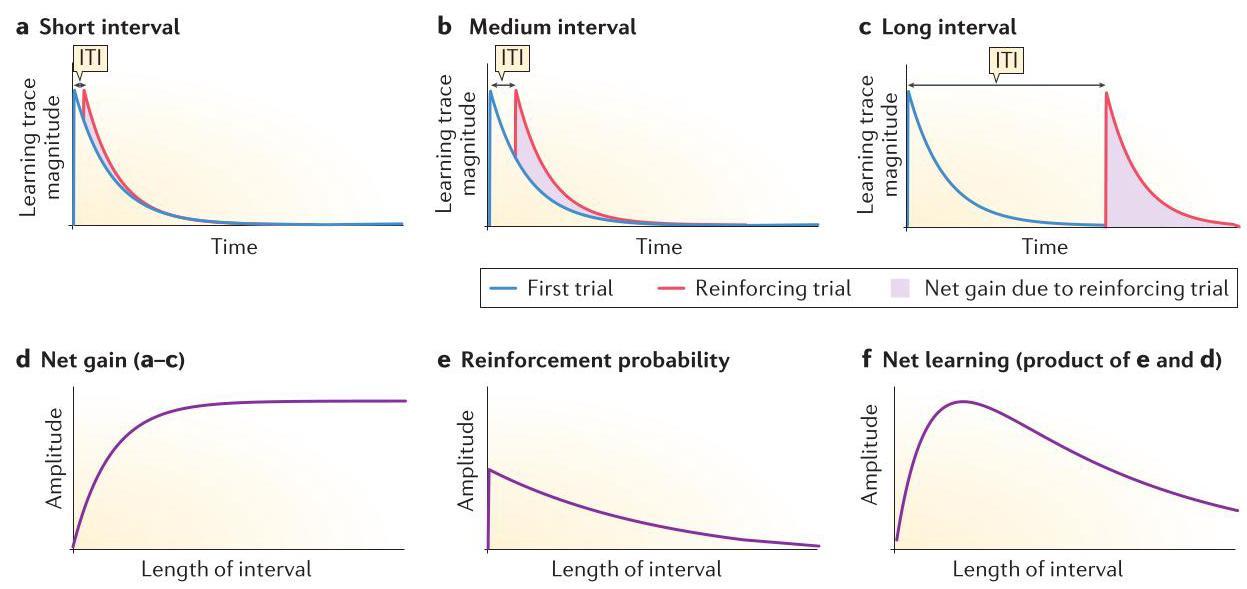
图1 | 学习痕迹动态如何产生最佳间隔的早期概念模型。如 Landauer 的早期模型所描述,间隔训练比密集训练在强化大脑中与记忆存储相关的某种痕迹方面更为有效,尽管这个概念模型并未对该痕迹的生化或结构形式作出具体假设。该模型认为,随着训练环节之间的刺激间隔延长,记忆形成的效果会提高,这是因为连续出现的短暂学习痕迹之间的时间重叠减少。这些学习痕迹本身并不构成记忆,但它们的综合效应有助于形成长期记忆痕迹。a-c | 图示展现了两次连续试验引发的学习痕迹。模型假设,对于每种试验间隔(ITI)长度,「强化试验带来的净增益」与红色区域面积成正比。间隔越短,学习痕迹的重叠越多,净增益越少。因此,强化试验在前一次试验的恢复期之后最为有效。在此概念模型中,幅度和时间单位均为任意设定。d | 随着刺激间隔延长,强化试验的累积效应或净增益增大。当连续学习痕迹之间的重叠减至零时,这种效应达到平稳状态。e | 随着时间进一步延长,另一个量——强化试验能够重新激活构成先前学习痕迹过程的概率——开始下降。f | 当较长间隔带来的强化净增益(来自 d 部分)与强化重新激活先前学习痕迹的缓慢下降概率(来自 e 部分)相乘时,便产生了使长期记忆痕迹强度最大化的最佳间隔。最佳学习间隔就是能在 f 部分中产生痕迹峰值水平的那个间隔。
Peterson 描述了一个类似的模型,该模型聚焦于言语学习的动态过程。此外,Wickelgren
通过假设记忆痕迹抵抗衰退的能力会随着痕迹在整个间隔学习过程中存在时间的增长而增强,从而扩展了记忆巩固理论。因此,经过间隔训练后,记忆痕迹不仅会变得更强,而且会极大地提高其抵抗衰退的能力。
时间的分子痕迹
在记忆分子机制的研究方面已取得了实质性进展。基于这些进展,本节将重点探讨间隔效应对长期记忆形成的潜在分子机制。
目前学术界已达成共识,学习过程至少部分是通过突触强度的变化(即突触可塑性)来实现的。例如,恐惧条件性记忆可以通过特定突触通路的长时程抑制(LTD)和长时程增强(LTP)分别被交替消除和恢复。因此,间隔学习所依赖的关键分子过程可能在于强化已形成的 LTP。
LTP 的可靠标志是树突棘的重塑和扩大,这些树突棘是与大多数兴奋性突触相关的小型突起结构。因此,研究集中式刺激与间隔式刺激后树突棘重塑的动态差异,很可能为理解间隔训练有效性的内在机制提供重要见解。使用大鼠海马切片的研究发现,由多次 theta 突发刺激诱导的 LTP 伴随着突触超微结构的广泛重塑
,而要实现 LTP 的最佳强化效果,需要后续间隔施加 theta 突发刺激,且刺激之间的间隔需要达到 60 分钟或更长时间
。受刺激的树突棘在超过 1 小时的时间内发生重塑,导致现有功能性突触后密度
和突触前活性区
扩大。突触处 AMPA 型和 NMDA 型谷氨酸受体数量的增加与 LTP 的幅度呈正相关。
关于间隔学习为何比集中学习在记忆形成中更有效,目前已提出两种涉及树突棘重塑的假设。这些假设有一个共同点,即学习过程中存在一个不应期,在此期间,两个紧密相连的刺激中,第二个刺激无法增强第一个刺激的效果(图 2a)。第一种假设认为,间隔而非集中的刺激重复能够克服不应期,导致一组树突棘反复增大并强化这些树突棘介导的突触连接(图 2b)。另一种非互斥的假设
是,特定分子过程使得后续的间隔刺激能够在那些最初没有增大的树突棘上诱导长时程增强(LTP)。在这种情况下,间隔而非集中的试验间隔使这些额外树突棘能够完成一个称为「启动」的分子过程。经过启动后,这些树突棘会被后续刺激强化并被整合到记忆痕迹中(图 2c)。目前,这种启动过程的分子组成尚不清楚。
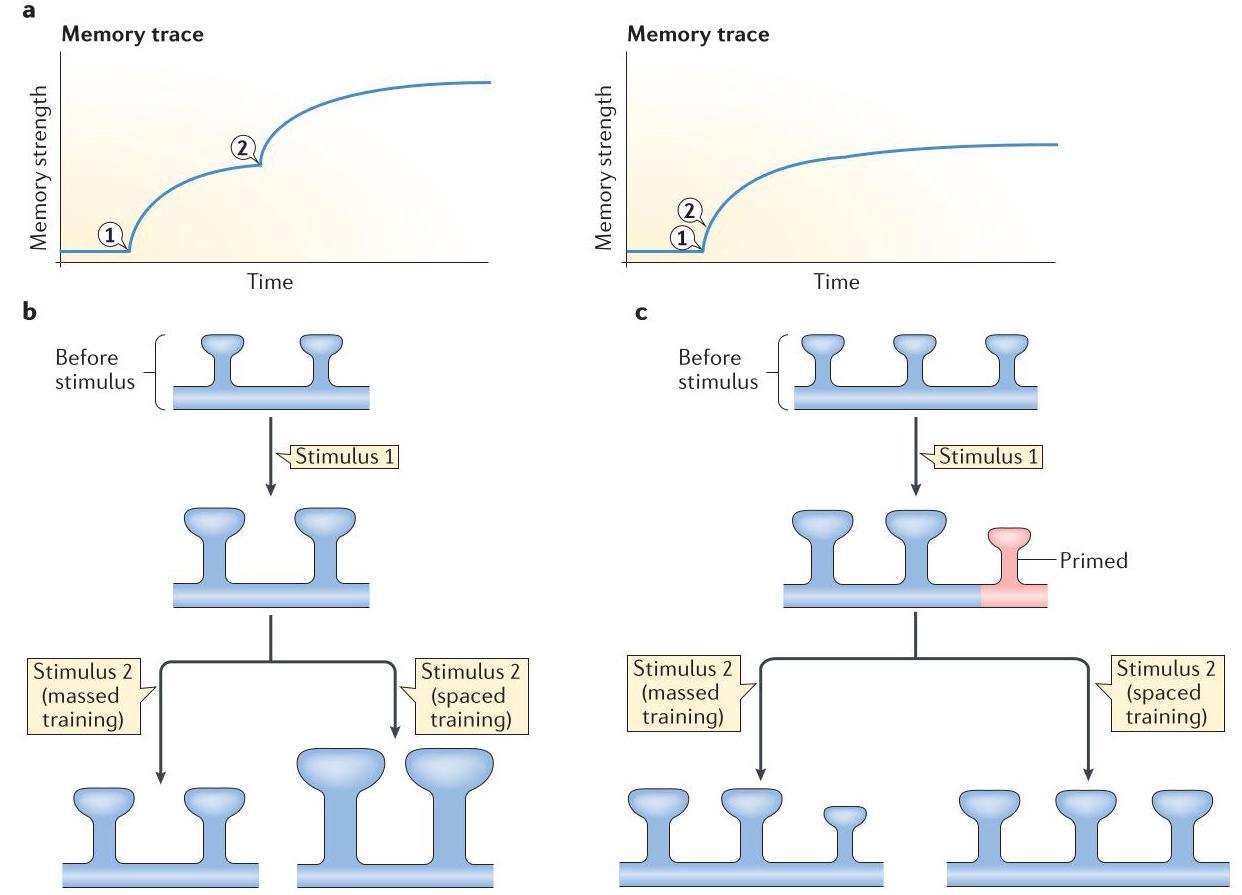
图2 | 间隔学习中突触强化的模型与假设。a | 在不应期状态模型中,间隔施加的刺激(左图;先施加刺激 1,经过较长时间后再施加刺激 2)能够累积增强记忆痕迹(蓝色时间曲线)。相比之下,密集施加的刺激(右图;刺激 1 后短时间内就施加刺激 2)无法累积增强记忆痕迹。b | 间隔训练中的累积性突触强化可能是由长时程增强作用(LTP)的渐进增强所致,这种增强可能表现为同一突触接触点强度的连续提升(如图所示,表现为同一突触后树突棘体积的连续增大)。因此,在描述间隔学习过程中突触强化的两个当前假设之一中,刺激 1 使一群树突棘体积增大。若刺激 2 紧随刺激 1 之后出现(如在集中训练中),它将无法进一步影响这些树突棘。然而,若刺激 2 在不应期之后出现(如在间隔训练中),它能够进一步增大同一群树突棘的体积。c | 另一种可能性是,LTP 的增强来自对新突触接触点的连续多轮强化。因此,在第二个当前假设中,刺激 1 仅增大了受影响树突棘的一部分,同时使其他树突棘处于启动状态。如果刺激 2 紧随刺激 1 之后出现(如在密集训练中),它不会产生任何效果。如果刺激 2 在较晚时间出现(如在间隔训练中),它不会进一步增大第一组树突棘的体积,而是会增大那些被刺激 1 启动但尚未增大的树突棘。
通过在大鼠海马切片中利用 Schaffer 侧枝-交叉联系投射,两项研究已经表征了间隔刺激如何招募额外突触连接。研究发现,当 theta 突发刺激以 10 或 40 分钟的间隔施加时,并不会累积增强 LTP(长时程增强)。然而,当间隔时间更长(60 或 90 分钟)时,在三次突发刺激后可观察到 LTP 的累积增强。每次 theta 突发刺激都会导致树突棘中肌动蛋白丝的聚合,这被认为是 LTP 稳定化的重要因素
。若第二次 theta 突发刺激在第一次刺激后 60 或 90 分钟施加,则会在那些看似未受第一次刺激影响的棘突中诱导聚合。这些数据并不表明连续的 theta 突发刺激会进一步增强同一组棘突的效能,而是表明第一次 theta 突发刺激在所有受刺激传入纤维的突触接触点启动了引发过程,但仅在部分接触点启动了巩固和增强过程。那些经历了引发但未巩固的棘突表现出约 60 分钟的不应期,表明引发过程需要时间完成(图 2a)。如果第二次 theta 突发刺激在不应期后施加,部分或全部已引发的棘突将经历巩固过程。这些数据与前段提出的第二个假设一致,因为第一次 theta 突发刺激似乎扩大并增强了一些棘突,而在其他棘突上只启动了引发过程。这些已引发的棘突随后可通过第二次 theta 突发刺激得到增强。
转录因子的动态特性及其相互作用也可以解释间隔训练的优越效果。持续数小时或更长时间的长时程增强(LTP)需要蛋白质翻译和基因转录,这一过程依赖于环磷酸腺苷反应元件(CRE)结合蛋白(CREB)等关键转录因子
。间隔训练之所以更有效,部分原因可能在于它提供了足够的时间让 CREB 等转录因子被激活、结合到启动子上,并诱导一轮转录,从而实现 LTP 的巩固
或突触的长时程促进(LTF)
。而在集中训练中,各试验之间的间隔过短,无法启动独立的转录周期。确实,在加利福尼亚海兔的感觉和运动神经元共培养实验中,间隔 5 次应用 5-羟色胺(5-HT,也称为血清素),每次持续 5 分钟,刺激间隔为 20 分钟(这是间隔训练的一种模拟方式),能够有效诱导持续 24 小时以上的长时程促进
;而连续应用 25 分钟的 5-羟色胺(这是集中训练的一种模拟方式)则无法产生可靠的长时程促进效果。
在这些感觉神经元中,转录激活因子 CREB1 的水平在间隔式 5-HT 处理后至少 24 小时内持续升高。CREB1 水平的这种长时间升高源于一个正反馈循环:该蛋白通过与 creb1 基因附近的 CRE 调控元件结合,增强了 creb1 自身(参考文献 54、55)以及其他被CREB1上调的基因表达。此外,在这些感觉神经元中,转录抑制因子CREB2的水平在处理后约 12 小时时出现显著下降
。CREB2 水平的这种下降结合 CREB1 水平的上升,很可能对应着基因诱导潜能的增强。因此,在处理后约 12 小时左右施加额外的 5-HT 刺激,可能会最优化地增强长时程促进作用(LTF)。
这些感觉运动突触的长期易化作用与一种简单形式的学习——撤退反射的长时程敏化(LTS)相关联。在体内实验中,四次间隔电刺激(刺激之间间隔 30 分钟)产生的 LTS 持续时间超过 24 小时,在训练后第 4 天仍能检测到微弱的残留 LTS;而如果连续 4 天每天重复一次这种间隔刺激方案,则会产生更强的 LTS,持续时间超过一周。这些数据表明,在该系统中,转录激活和基因表达的动态过程具有可以在多天内累积的缓慢组分,从而形成长久的记忆。
最新研究数据还表明,在海马体中,CREB 和 CCAAT 增强子结合蛋白(C/EBP)——另一种对长时程增强作用(LTP)至关重要的转录因子——能够在学习后持续活跃数小时之久。大鼠在接受抑制性回避训练后,脑源性神经营养因子(BDNF)表达和 C/EBP 表达的晚期峰值出现在训练后约 12 小时,若在此时抑制 BDNF 的活性,将会阻断记忆的维持过程。这些 BDNF 的动态变化源于一个正反馈循环:
的诱导促使 Bdnf 上调表达,而 BDNF 水平的相应增加又进一步激活 C/EBP 信号通路
。尽管这种缓慢的反馈循环是由单次训练而非间隔训练触发的,但对这些动态机制进行建模研究,并探究在训练后约 12 小时(此时 C/EBP 水平升高)进行额外的间隔试验、导致第二次
诱导是否能最佳地强化学习,将会十分有价值。另一个预测是,如果重复刺激的间隔过短,不足以允许必要的转录调控和 Bdnf 表达来激活这一反馈循环,那么密集刺激的效果就会降低。关于从学习的计算模型中可获得的洞见,将在本文后续部分进行讨论。
从较短的时间尺度来看,第二信使、激酶和磷酸酶的动态变化可能是间隔训练优于集中训练的关键机制。一项小鼠研究发现,当物体识别试验间隔为 15 分钟而非 5 分钟时,海马体和大脑皮层中 CREB 的磷酸化与激活水平显著提高。蛋白磷酸酶 1(PP1)似乎是这种间隔效应的必要条件,因为抑制 PP1 后,即使是较短的间隔也能激活 CREB。一项涉及加尼福利亚海兔感觉神经元-运动神经元共培养的研究
发现,在集中刺激(连续应用 5-羟色胺)过程中,蛋白激酶 C(PKC)的激活程度远高于间隔刺激(应用间隔 15 分钟)。已知 PKC 会下调蛋白激酶 A(PKA)的活性,而 PKA 的激活对长时程促进(LTF)至关重要;因此,这些数据揭示了信号通路间的交叉调控机制,表明集中训练期间较强的 PKC 激活会部分抑制 LTF 的形成。
另一项研究则描述了果蝇中丝裂原活化蛋白激酶(MAPK)及其磷酸酶的动态特性。在嗅觉学习实验中,每次间隔训练都能产生一个独特的MAPK活性波,而集中训练的试验间隔过短,无法产生这种独特的活性波。因此,研究者推测有效学习依赖于产生这些独特的MAPK活性波。
另一种基于磷酸化的机制也被假设能够解释间隔效应在果蝇中的有效性。研究发现,即使在总训练时间相同(因此密集训练的呈现次数更多)的情况下,间隔(15 分钟)训练比密集(1 分钟)训练在诱导嗅觉学习方面更为有效。果蝇 CREB 蛋白有两种异构体——dCREB2-a 和 dCREB2-r——它们分别能够激活和抑制基因转录。研究者提出
,这些异构体的磷酸化动力学存在差异:较为分散的间隔试验所产生的激酶激活足以磷酸化并激活 dCREB2-a,而 dCREB2-r 只能在密集试验条件下被有效磷酸化。因此,采用间隔训练可以最大限度地激活基因转录,并可能通过激活促进因子 dCREB2-a 而不激活抑制因子 dCREB2-r,从而诱导长期记忆的形成。
计算机模拟研究支持了这一机制的可行性,但该假说尚未得到实验验证。然而,要解释为什么在总训练时间相等的情况下密集训练效果仍不如间隔训练,很可能需要一种类似的机制——即基于长期记忆形成激活剂与抑制剂之间的竞争,其中抑制剂仅在短间隔条件下被激活。
在加利福尼亚海兔的实验中,研究人员发现,当施加两次电击诱导长时程敏化(LTS)时,刺激间隔为 45 分钟时产生的 LTS 效果最显著。而当间隔为 15 分钟或 60 分钟时,则无法诱导 LTS。这个 45 分钟的最佳间隔与丝裂原活化蛋白激酶(MAPK)的激活密切相关。在单次 5-羟色胺(5-HT)刺激或单次电击后,MAPK 的激活水平在试验后约 45 分钟达到峰值
;因此,45 分钟的间隔可能最有效地增强 MAPK 的作用。研究表明,这种延迟性 MAPK 激活需要蛋白质合成
,尽管导致 MAPK 活性在约 45 分钟达到峰值的上游调控机制尚未被充分阐明。无论如何,这些研究的关键发现是:延迟激活的 MAPK 与间隔刺激有效诱导长期记忆形成密切相关。
同样地,在小鼠实验中,以 60 分钟为间隔的训练(而非 20 分钟或 120 分钟)能够增强野生型小鼠和脆性 X 综合征模型小鼠(脆性 X 智力障碍 1 基因(Fmr1)敲除小鼠)的物体识别学习能力,这至少部分是通过增加胞外信号调节激酶1(ERK1,也称为 MAPK3)和 ERK2(也称为 MAPK1)在突触处的激活实现的。之所以预测 60 分钟的间隔对学习最为有利,是因为先前研究发现,间隔 60 分钟的刺激能够增强野生型啮齿动物的长时程增强作用(LTP)
。因此,在加利福尼亚海兔、黑腹果蝇和哺乳动物中,MAPK 的激活似乎都是构成「间隔效应」分子机制的重要组成部分。
这些分子机制中的一些似乎支持这样一种理论:间隔训练之所以有效,是因为它们强化了同一记忆痕迹或一组已增强的突触连接。然而,间隔刺激也可能通过招募新的突触来增强记忆。ERK1 和 ERK2(ERK1/2)的激活对某些形式的长时程增强(LTP)是必需的,一项研究
比较了三次间隔性强直刺激(间隔 5 分钟)与三次密集刺激(间隔 20 秒)后大鼠海马锥体神经元中 ERK1/2 的激活情况。研究发现,间隔刺激后具有活性 ERK1/2 的树突数量约为密集刺激后的两倍,这表明间隔试验可能为 LTP 招募分布在不同树突上的额外突触。因此,多种分子和细胞机制似乎共同促成了间隔训练的有效性,它们可能以并行或串行方式发挥作用。
间隔训练使用的试验间间隔范围极其广泛,从秒到数天不等(图 3)。例如,在蜜蜂嗅觉学习中,即使短至 1 分钟的间隔也能实现有效的间隔训练。这种短暂的间隔可能允许增强由先前试验产生的短寿命第二信使(如环腺苷酸,cAMP)的活性。激酶激活的动态过程构成了间隔效应的另一个基础。在加尼福尼亚海兔、黑腹果蝇和哺乳动物中,上述数据表明,常见报告的间隔时间从约 5 分钟到 1 小时不等,可能有助于增强对长时程增强或长时程促进(LTF)至关重要的关键激酶活性,并巩固树突棘中的结构变化。
对于特定的实验方案和生物系统,有效学习所需的最小刺激间隔时间,很可能对应于允许每次刺激能够独立地对某个速率限制性生化过程做出贡献所需的时间间隔。以蜜蜂的快速嗅觉学习为例,其有效间隔为 1 分钟,此时的速率限制性过程可能是第二信使的积累或激酶的快速激活。若刺激间隔过短,速率限制性过程的时间尺度可能就太长,无法让每次短暂的刺激分别对该过程产生影响——一组紧密排列的刺激反而会被整合为单一刺激。而当间隔达到 1 分钟或更长时,每次刺激就能够为速率限制性过程提供一个离散的增量贡献,从而实现有效学习。对于 Gall、Lynch 及其同事们开发的间隔性 LTP 方案,需要 40-60 分钟的间隔才能使连续的 theta 突发刺激进一步增强 LTP。在这种情况下,速率限制性过程则有所不同——可能是某种未明确指出的激酶的较慢激活或其他细胞内信号传导事件,其时间常数接近最小有效间隔约 40 分钟。明显短于此间隔的刺激将无法产生速率限制性过程的累加效应,因此不会引起额外的 LTP。
对于其他系统,转录激活的动态过程可能遵循类似的假设。如前所述,在加尼福尼亚海兔的长时程促进作用(LTF)和长时程敏化作用(LTS)中,转录可能构成一个速率限制性过程,这有助于决定间隔训练的有效性。然而,值得注意的是,即使是像蜜蜂嗅觉学习这类涉及短时间间隔的系统,有效形成长期记忆仍然依赖于转录和翻译的激活,这些过程发生在被这些时间间隔激活的细胞内信号通路的下游。记忆痕迹的再激活可能构成另一个时间基础,这支持了文献报道中最长的有效间隔——约一周
。这些较长的时间间隔可能会重新激活并加强已巩固的突触增强模式,这些模式对应于由神经网络活动维持的记忆痕迹
。具有这些长时间间隔的间隔学习会重新激活这些突触上的关键成分,特别是重新激活这些突触上的 NMDA 受体。使用可诱导和可逆的 NMDA 受体基因敲除的研究已经证明,这种 NMDA 受体的再激活(部分也可能源于自发的神经活动)是维持远期记忆存储所必需的
。在增强的突触处维持关键激酶和其他分子持续活跃状态的正反馈循环也可能有助于这种长期记忆存储
。未来研究的一个重要方向是进一步探索支持人类间隔学习的分子过程,特别是那些涉及一天或更长试验间隔的学习过程。
上述工作揭示了一个重要含义:间隔训练可能同时涉及多个时间尺度的间隔(图 3)。确实,在加尼福尼亚海兔中,一个有效的长时程敏化(LTS)训练方案如下:四次训练间隔 30 分钟,然后以 1 天为间隔重复四次这样的训练组。因此,至少在某些情况下,训练方案的时间结构呈现出层次化特征,即较短的训练方案嵌套在较长的方案之中。
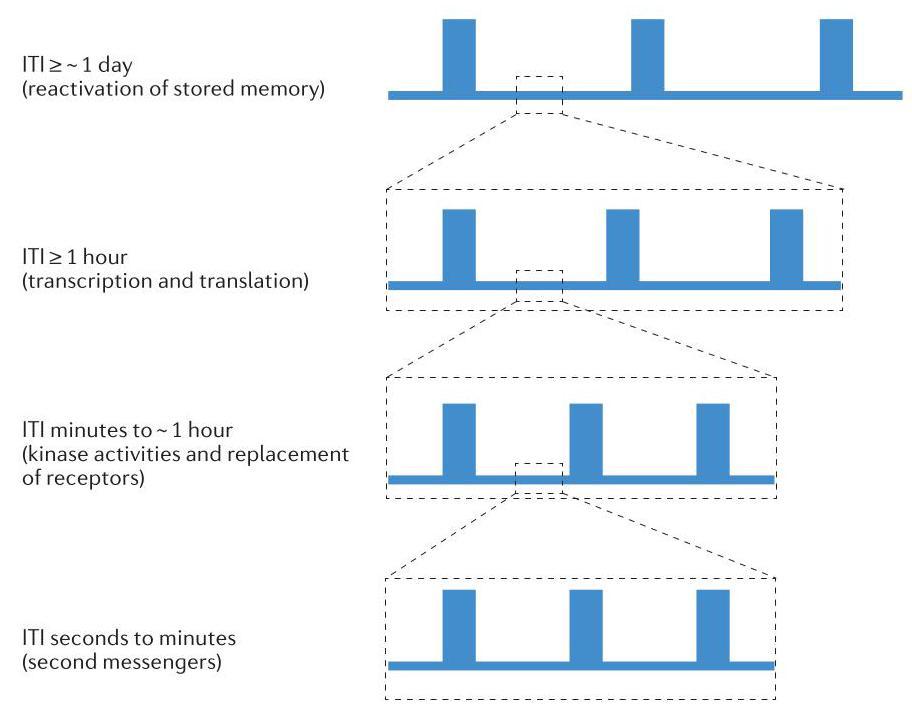
图3 | 不同长度的间隔可能通过各种机制来增强学习效果。对于相对较短的试次间隔(ITIs,如图底部所示),连续的学习试次可能会与前一次试次产生的二级信使峰值水平重叠并强化它。在每条轨迹中,单个矩形代表单次学习试次,轨迹间的汇聚线表示向上移动时时间尺度的延长。对于稍长的间隔(几分钟到约 1 小时),连续的学习试次可能会强化由前次试次激活的激酶活性峰值,并引发已预先准备好的树突棘的长时程增强。这种长度的间隔在海马体中也可能是必需的,用于允许在受刺激的树突棘处替换失活的受体,从而使后续的刺激重复能够增强这些树突棘。对于约 1 小时或更长的间隔,后续试次可能会与前次试次引起的转录因子活性和基因表达峰值相吻合。对于最长的间隔(数小时或更长时间),后续试次可能会重新激活并进一步增强已巩固的记忆痕迹。所有这些过程都可能促进长期记忆的巩固,这在许多(如果不是全部)物种中都是如此。然而,根据特定间隔学习方案中使用的间隔长度,某种特定类型过程(例如,激酶激活)的动态可能特别有助于间隔学习的有效性。此外,一个时间域(例如,1 天)的试次可能是单一事件,但也可能构成另一个时间域(例如,分钟到小时)的间隔试次组合。例如,在加尼福尼亚海兔中进行长时程敏化训练的有效方案是使用四次试验,间隔为 30 分钟,并将此组合重复四次,每次间隔 1 天
。因此,一些有效的训练方案由不同时间域的训练会话层次结构组成,将较短的会话嵌入在较长的会话中。在此图示中,间隔显示为规则分布,但不规则的间隔分布可能会产生更有效的学习效果(图 4)。
上述讨论以及大多数实证研究主要关注的是有效间隔学习或长时程增强(LTP)累加所需的典型或最小试验间隔或刺激间隔。只有少数研究在特定系统(即特定物种和特定刺激方案)中同时确定了有效间隔的最小值和最大值。一项研究发现,在海马切片实验中,强直刺激(tetani)之间间隔 5-10 分钟对诱导 LTP 最为理想,这些间隔产生了相似水平的 LTP,而更长或更短的间隔则导致 LTP 水平和 ERK1/2 激活程度降低。在加尼福尼亚海兔中,电刺激间隔 45 分钟能有效诱导长时程敏化,而 15 分钟或 60 分钟的间隔则无效
。如前所述,该研究的作者假设 MAPK 激活达到峰值与第二次刺激的时间吻合对有效学习至关重要。此外,在小鼠的物体位置记忆形成实验中,三次训练之间间隔 60 分钟是有效的,而 20 分钟或 120 分钟的间隔则无效
。
由于此类研究数量有限且缺乏对相关分子过程的充分表征,目前我们尚无法详细阐述细胞内信号通路如何协同作用以产生最小和最大学习间隔。关于最大间隔,一个合理的定性假设是:每次学习尝试或刺激会产生一个独立的、相对短暂的生化痕迹,而要实现有效的间隔学习,这些痕迹必须在时间上重叠并累积,这种累积效应的强度能够驱动长期突触增强。这一动态过程与 Landauer 概念模型中痕迹必须重叠的原理相类似(图 1a-c)。当间隔超过最大限度时,各个生化痕迹会衰减消失,因而无法产生重叠效应。
近期数据和学习理论
那些被提出可以提高间隔训练效果的生物化学和形态学机制是否与传统认知理论相符合?目前,大部分现有的细胞数据似乎都与加工不足理论相兼容,特别是它的两种变体:巩固理论和缺乏认知排练理论。在巩固理论中,密集试验之间的间隔被认为太短,不足以完成记忆痕迹的巩固和随后的累加效应。而在认知排练理论中,密集试验被认为会比间隔试验产生更少的认知排练或自主重激活,因此记忆的累积巩固和持久性也就更弱。
海马 LTP(长时程增强)在连续 theta 突发刺激之间需要约 1 小时的不应期才能产生递增的增强效果,这一发现似乎支持第一种变体理论,即短时间间隔不足以完成记忆痕迹的巩固和随之而来的累加。这一不应期对于完成第一次 theta 突发刺激后那些被刺激但尚未增强的树突棘的启动过程至关重要。这种启动使得树突棘能够在第二次刺激后增强,从而形成生物化学刺激痕迹(图1d,2a)。Kramár 等人
指出,在海马切片中,在诱导第一次 LTP 增量后长达 4 小时内仍然可以诱导额外的增强
。与启动相关的刺激痕迹可能至少需要 4 小时才能衰减。这种较长的痕迹持续时间可能为优化训练试验提供了一个广泛的时间窗口。
在大鼠海马切片实验中,θ 频率爆发式刺激会导致受刺激的树突棘上的整合素受体发生蛋白水解失活。这些受体随后在约 40-60 分钟的时间内通过囊泡运输被新的受体所替代。研究假设
,在这些突触接触位点,后续的 θ 频率爆发式刺激无法诱导树突棘增大或产生长时程增强(LTP),直至这种受体替换过程完成,这解释了为何需要约 1 小时的不应期,才能使第二次θ频率爆发式刺激产生额外的 LTP。这种受体替换过程可能至少部分构成了前文所讨论的树突棘「启动」机制。这些假设的动态过程可能与加工不足理论相一致,即受体替换作为一个必要过程,只能在间隔试验的间隔期间发生(图 3)。
转录因子的激活同样构成一种生化痕迹,在某些系统中,训练可能只有在试验间隔足够长,使每次试验能够诱导一轮独立的转录和翻译过程时才有效。类似地,短暂(集中)的试验间隔可能无法产生足够水平或持续时间的活化 MAPK 或其他激酶,从而无法支持长期记忆的巩固。
加工不足理论的一种变体认为,只有间隔性试验才能产生足够的认知排练或记忆再激活,从而支持长期记忆的巩固。这一观点与实证研究发现相吻合:间隔约 1 小时的重复 theta 突发刺激能够通过增强先前刺激所预激的树突棘,从而招募额外的树突棘。在这个过程中,记忆再激活与 theta 突发刺激类似,因为两者都能启动预激和增强机制。同样,重复的记忆再激活可能会诱导参与长时程增强(LTP)的基因进一步转录,如 C/ebp 和其他 CREB 激活的基因,从而进一步巩固长期记忆。
要将加工不足理论的这一变体与最新的细胞和分子数据更紧密地联系起来,我们还需要假设:记忆再激活会重新激活在原始学习过程中被激活的部分相同神经元和突触。通过这种方式,记忆排练和学习试验能以相同的机制强化记忆。这一假设虽然合理,但仍需进一步的实证研究验证。尽管需要更精细的分析,一项运用功能性磁共振成像(fMRI)进行的言语学习研究支持了这一假设。该研究发现,与言语记忆排练相关的特定脑区——左侧额叶盖部,在词对联想的间隔学习过程中比在集中学习过程中表现出更高的活跃度。值得注意的是,这些假设的记忆再激活发生在约 1 小时或更长的时间尺度上,与短时间尺度(几秒或约 1 分钟)内的自主记忆排练有所不同。大量行为证据表明,后一种自主的短期排练对间隔学习并非必要
。
缺陷加工理论的其它变体,特别是那些关注习惯化或在集中呈现期间缺乏主动注意力的理论,似乎与当前的单神经元数据不易建立联系。这些变体也被认为难以解释某些言语学习的实验观察结果。关于编码变异性理论,我们需要的是神经元网络动态数据,而非单神经元数据,以确定该理论所要求的记忆与环境背景的绑定在多大程度上发生。同样,为了评估学习阶段提取理论中所需的后期试验记忆是否与早期试验记忆相绑定,也需要类似的数据支持。随着我们对记忆网络动态认识的深入,重新评估这些相互竞争的间隔学习理论将变得极为重要。事实上,不同理论可能在不同记忆系统中具有不同程度的适用性。
不规则间隔可以增强学习
优化间隔效应的尝试通常基于试错法进行。因此,在动物和人类研究中使用的大多数(如果不是全部)训练方案可能都不是最优的。几乎所有学习范式中,训练间隔都是固定的,尽管有一种间隔训练范式会逐渐延长学习环节之间的间隔。然而,一项元分析
和一项文本学习研究
均未发现充分证据表明这种方法在促进长期记忆形成方面具有显著优势。
显而易见,使用间隔训练方案所观察到的学习效果提升,至少部分可以通过训练试验与记忆形成相关的潜在细胞和分子机制之间的动态关系来解释(图 3)。但是,反过来是否也成立呢?我们能否利用对记忆机制动态性的了解,通过预测最佳训练方案(可能包含不规则的训练间隔)来增强记忆处理过程?一种方法是构建记忆形成背后的生化级联反应模型,并通过模拟来快速测试不同训练方案的有效性。近年来,研究者已经建立了描述刺激如何转导为长时程增强(LTP)的生化反应动态模型
。这些模型包含能够模拟和预测关键分子种类活动动态的微分方程。模拟已经成功重现了 LTP 诱导过程中丝裂原活化蛋白激酶(MAPK)的活动动态
。模型还模拟了蛋白激酶A(PKA)、钙/钙调蛋白依赖性蛋白激酶 II(CaMKII)以及其他关键酶和 LTP 诱导过程中下游转录因子的活动时间曲线
。这些模型中的每个信号级联通路都展现出特征性的活动时间模式;因此,很可能某些不规则的间隔序列将被预测为最大化 LTP 诱导的最佳方案。例如,在激酶活性达到峰值的时刻递送后续训练刺激,可能会最优地强化学习效果。
我们实验室的一项研究构建了一个模型,描述在加尼福尼亚海兔中 5-羟色胺(5-HT)诱导的 PKA 和 ERK 信号通路如何对长时程促进(LTF)起关键作用。在该模型中(图 4a),PKA 和 ERK 激活对 LTF 的必要性被简化为一个称为「诱导因子」的变量。这个诱导因子的值与 PKA 和 MAPK 活性的乘积成正比。模型预测,LTF 和长时程敏化(LTS)的强度会随着诱导因子峰值的增加而提高。研究团队模拟了一万种不同的实验方案,每种方案包含五次试验,试验间隔为 0-45 分钟(图 4b)。计算研究能在相对短时间内模拟和预测如此多方案的效果,这正是其相较于实证研究的显著优势。模拟结果显示,在所有方案中,密集型方案(图 4b)产生的诱导因子峰值最低,这与实验数据一致——密集应用 5-HT 无法产生 LTF
。产生诱导因子最高峰值的「最佳」方案被称为「增强」方案(图 4b),其特点是具有不规则的间隔时间。而被称为「标准」方案的模式(五个 5 分钟的 5-HT 脉冲,每次间隔 20 分钟)(图 4b)已在实证研究中被用于诱导 LTF 约 30 年
。这种标准方案产生的诱导因子峰值居中,预计其有效性也处于中等水平(图 4c)。这些预测已通过实验得到验证。「增强」方案产生的 LTF 和 LTS 强度确实超过了标准方案
(图 4d)。对这种 LTF 增强现象的解释,与现有数据相符
,如下:每次 5-HT 脉冲后,PKA 活性迅速上升并快速下降(图 4c)。而 MAPK 活性上升和下降的速度较慢,在脉冲后约 45 分钟才达到峰值。前四个脉冲引发MAPK活性的逐渐增强,在最后一个脉冲时达到高峰。最后一个脉冲则激活 PKA,使 PKA 的峰值与 MAPK 激活的峰值大致同时出现,从而使诱导因子最大化,产生最强的预期LTF效果。
如果不规则间隔的刺激方案能够增强正常学习能力,那么模型化方法是否也能预测出能恢复因基因突变或其他生理损伤而受损学习能力的方案?近期一项研究对此假设进行了检验。CREB 结合蛋白(CBP)是一种乙酰转移酶,也是多种转录因子(包括磷酸化CREB(pCREB))的必要辅激活因子。CBP 还是长期记忆巩固过程中的必要成分
。降低 CBP 活性的突变会导致一种名为鲁宾斯坦-泰比综合征(RTS)的人类遗传疾病
,该疾病与智力障碍和学习缺陷相关,而
小鼠则表现出长时程增强作用(LTP)和长期记忆受损
。最近的研究
通过小干扰 RNA(siRNA)技术敲低加尼福尼亚海兔感觉神经元中的 CBP 来抑制长时程促进作用(LTF)。在这项研究中,研究者扩展了之前用于预测能增强 LTF 的最佳不规则间隔方案的模型
(图 4a),以表示
的诱导过程,这是一种对 LTF 至关重要的转录因子
。在模拟不同间隔方案效果时,研究者将磷酸化C/EBP(pC/EBP)的峰值水平越高视为预示LTF效果越强的指标。模拟结果显示,当 CBP 水平减少到与 siRNA 效果相当的程度时,pC/EBP 水平显著下降。研究预测,一种具有不规则间隔的「救援」方案可以恢复 pC/EBP 的峰值水平,从而恢复 LTF。实验验证表明,这一救援方案确实能在加尼福尼亚海兔中恢复正常的 LTF。类似地,另一种预测的不规则间隔救援方案也成功地逆转了因 siRNA 敲低 CREB1 而导致的 LTF 缺陷
。
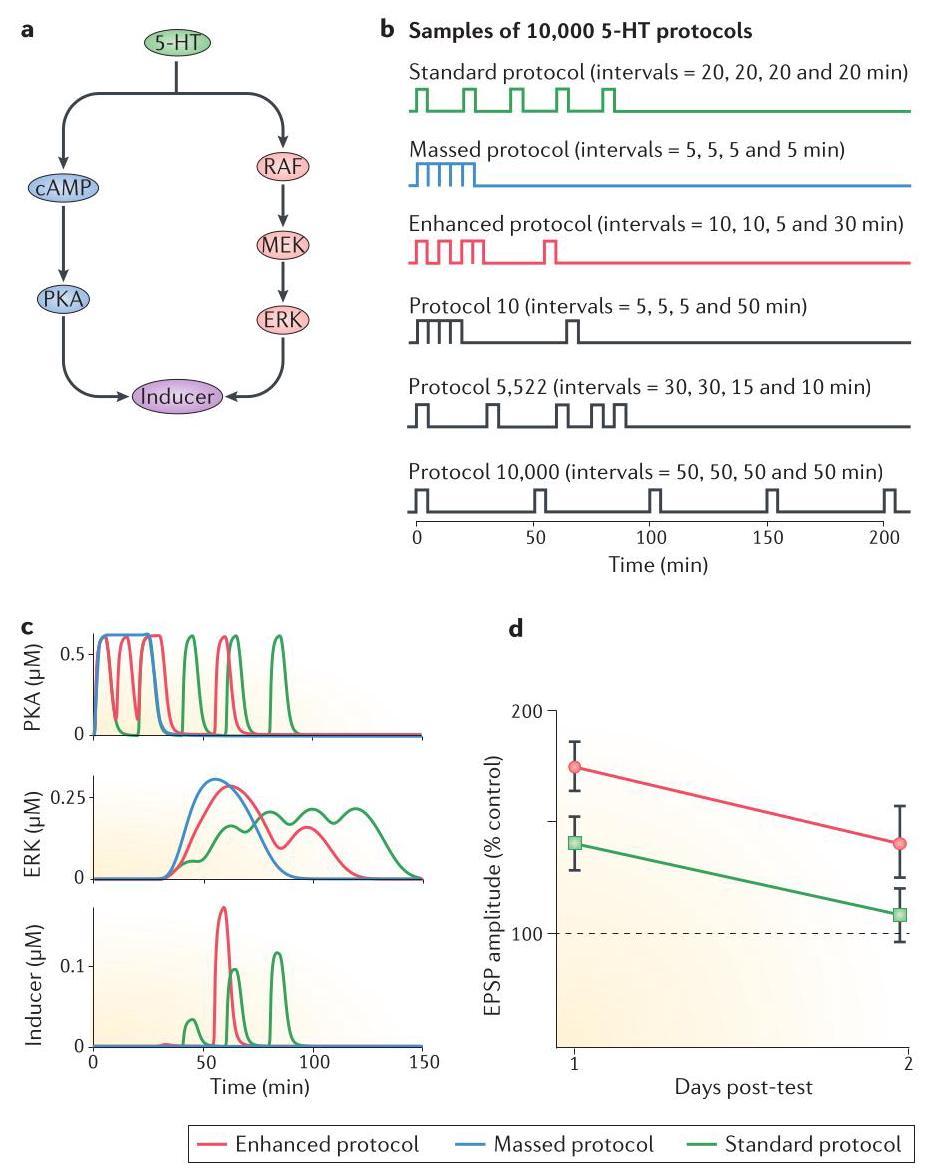
图 4 | 一个成功预测不规则间隔学习方案更高效果的模型动力学。a | 一个简化的数学模型描述了两种关键激酶的激活及其效应,这些激酶对长时程促进(LTF)至关重要,而LTF是一种简单学习形式——长时程敏化的细胞相关物。短时间施加 5-羟色胺(5-HT)通过增加二级信使环磷酸腺苷的水平来激活蛋白激酶 A(PKA),并通过 RAS-RAF-MEK 级联途径激活丝裂原活化蛋白激酶(MAPK)的细胞外信号调节激酶(ERK)亚型。PKA 和 ERK 至少部分通过对转录因子的磷酸化进行相互作用,从而诱导 LTF。在该模型中,变量「诱导因子」代表 PKA-ERK 的相互作用。模型假设诱导因子的峰值越高,预测的 LTF 幅度就越大。b | 在模型中模拟的 10,000 个 5-HT 方案中的六个示例。所有方案均由五个 5 分钟的 5-HT 脉冲组成,以矩形波形式呈现,脉冲间隔选择为 5 分钟的倍数,范围在 5-50 分钟之间。标准方案(绿色曲线)是体外LTF研究中最常用的方案。增强方案(红色曲线)产生了诱导因子的最大峰值,而集中方案(蓝色曲线)则产生了最小峰值。标准方案具有统一的 20 分钟脉冲间隔,而增强方案具有不均匀的 10、10、5 和 30 分钟间隔。集中方案在 5-HT 脉冲之间没有间隔。c | 标准方案(绿色曲线)、增强方案(红色曲线)和集中方案(蓝色曲线)响应下激活的 PKA、激活的 ERK 以及诱导因子的模拟时间变化曲线。d | 在对模型预测的实验验证中,通过兴奋性突触后电位(EPSPs)振幅增加的百分比测量,增强方案诱导的 LTF 显著大于标准方案产生的 LTF。图的部分 c 和 d 来自参考文献 85,Nature 出版集团。
尽管这些实证研究是在加尼福尼亚海兔中进行的,但值得注意的是,从加尼福尼亚海兔等简单模式生物到哺乳动物,记忆的关键分子机制在很大程度上是保守的。例如,长时程促进(LTF)和长时程增强(LTP)都依赖于蛋白激酶 A(PKA)和细胞外信号调节激酶(ERK)的激活
,同时也依赖于磷酸化 CREB 和 CREB 结合蛋白(CBP)协同诱导基因表达
。长期易化作用(LTF)依赖于转录抑制因子 CREB2 的失活
。类似地,解除由 ATF4(CREB2 的哺乳动物同源物)导致的转录抑制,对维持海马体长时程增强(LTP)似乎也很重要
。因此,加尼福尼亚海兔的研究结果表明,在包括哺乳动物在内的复杂生物中,可能能够通过计算方法预测多种学习或训练方案的有效性,而这一过程仅依靠实证研究来完成则不切实际。
既然对底层生化级联反应的了解能帮助开发模型预测最佳训练方案,模型是否也能用于预测改善记忆的药理靶点呢?现在似乎正是采用这种方法的适当时机。例如,如果模拟的 LTP(长时程增强)缺陷能通过对应于已知药物协同效应的参数组合变化得到修复,这些「最佳」参数组合可能会为在动物模型中测试的药物组合提供优先选择依据。最近的一项研究迈出了第一步,该研究通过模拟 LTP 诱导和 CREB(环磷腺苷反应元件结合蛋白)的转录调控,并通过调整模型参数来模拟药物对 LTP 的影响。在这个模型中,LTP 诱导的强度表现为突触权重变量的增加。研究首先模拟了鲁宾斯坦-泰比综合征(RTS)
小鼠模型中观察到的 LTP 损伤。然后,基于这个模拟,研究者以符合合理单药效应的方式调整参数。然而,没有任何单一药物效应能完全恢复 LTP。因此,研究者考虑了参数的成对变化,对应于可能的药物组合效应。两组参数变化被确定能够恢复 LTP。第一组是组蛋白乙酰化速率常数的增加(对应于乙酰转移酶激活剂的应用)与刺激诱导的 cAMP 水平增加持续时间的延长(对应于 cAMP 磷酸二酯酶(PDE)抑制剂的应用)的组合。第二组则是 PDE 抑制剂与去乙酰化酶抑制剂的组合。这两组组合都表现出加性药物协同作用——即联合药物效应超过了各个药物效应的简单加和,这通过一个简单的加性测量得以量化(图 5)。随后另一研究小组的实证研究确实发现,PDE 抑制剂与去乙酰化酶抑制剂的组合能有效恢复阿尔茨海默病小鼠模型中的 LTP 缺陷
。这些策略的进一步拓展可能类似地预测,并通过实验验证,当药物治疗与计算机设计的间隔训练方案结合时对突触可塑性的增强效果。
药物协同效应
在联合用药治疗中,药物组合的协同效应是指其产生的效果超过了将各个药物视为独立且不存在相互作用时所预期的效果。
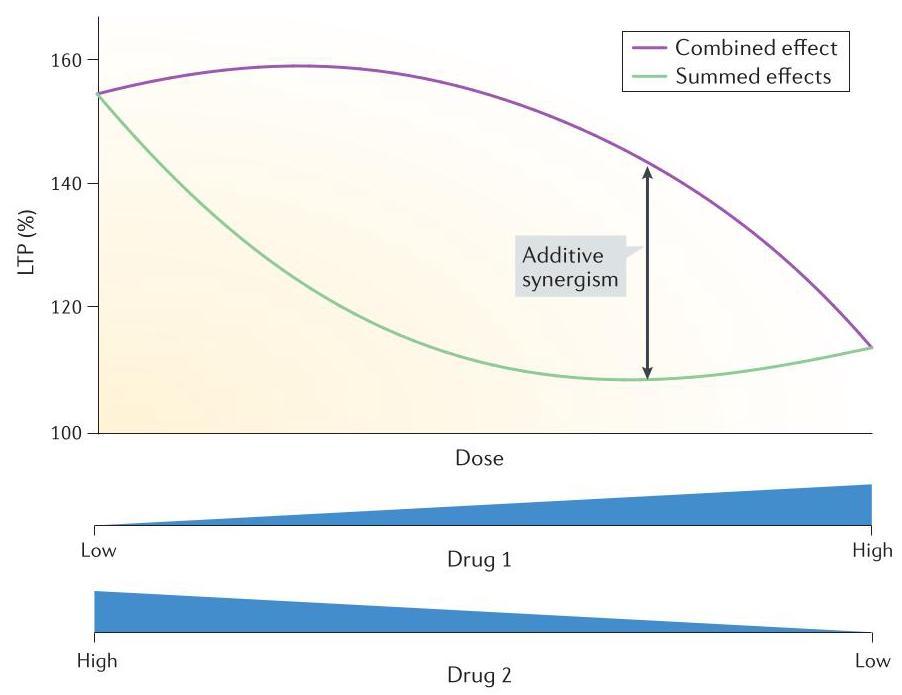
图 5 | 模型预测一对药物可协同作用增强长时程增强效应。CREB 结合蛋白(Cbp)突变会损害海马长时程增强效应(LTP)并影响小鼠的学习能力, 小鼠被认为是模拟人类 Rubinstein-Taybi 综合征某些特征的模型
。我们开发了一个模型来研究是否可通过药物干预克服这种LTP损伤。此图是通过一系列模拟两种药物对 LTP 诱导影响生成的。在模型中,LTP 表示为突触权重变量的百分比增加。在无药物干预情况下,高频强直刺激诱导的模拟 LTP 受到严重抑制。
突触权重仅增加 50%,而未突变
的突触权重增加了 148%。每种药物的作用被简化为动力学参数值的变化。在这组模拟实验中,我们同时调整了两种药物的剂量——药物 1(环腺苷酸磷酸二酯酶抑制剂)和药物 2(乙酰转移酶激活剂)。药物 1 的作用通过降低 cAMP 降解速率常数来模拟,而药物 2 则通过增加组蛋白乙酰化速率常数来模拟。随着药物 1「剂量」(速率常数变化幅度)的增加,同时减少药物 2 的剂量,共模拟了 80 对药物剂量组合。结果显示,两种药物均能显著增强 LTP。单独使用药物 2(图表左端点)时,LTP 达到 155%;单独使用药物1(图表右端点)时,LTP 为 116%。当两种药物同时使用且各自剂量较小时,观察到中等程度的LTP增强(联合效应曲线)。这组模拟进一步表明,加性协同效应在较广范围的药物剂量内持续存在。加性协同效应以黑色双箭头表示,即两种药物同时应用时的 LTP 模拟值(联合效应曲线)与分别单独应用后效果相加的LTP模拟值(效果总和曲线)之间的差异。
未来发展方向
有充分理由相信,在不久的将来,我们将能够开发出更具预测性的模型来确定学习试验之间的最佳间隔时间。这一乐观预期源于用于构建此类模型的分子数据正在迅速积累,这些数据能够清晰描述对长时程增强(LTP)和长期记忆至关重要的信号通路动态。然而,尽管在理解间隔效应的分子机制方面已取得显著进展,此效应的某些方面仍无法被现有模型完全解释,这构成了未来研究的重要方向。
例如,在人类语言学习中,研究发现有效间隔学习的试验间隔长度与记忆保留间隔(即最后一次训练试验到记忆保留测试之间的间隔)之间存在一种有趣的正相关关系。当保留间隔相对较短(~1 分钟至 2 小时)时,~1 分钟到 3 小时范围内的训练间隔比 2 天或更长时间的训练间隔产生的语言学习效果更好。当保留间隔延长至 1 天时,1 天的训练间隔比极短(<30 秒)的间隔学习效果更佳。而对于保留间隔长达 6 个月的语言学习,7 天的训练间隔则优于 3 天的间隔
。
训练间隔与保留间隔之间的这种正相关关系表明,较长的训练间隔倾向于形成寿命更长的记忆痕迹。在分钟与小时的时间尺度范围内,较长的记忆痕迹寿命合理地对应于较长训练间隔所激活的转录增加。然而,这一解释可能不足以解释 1 天与多天训练间隔之间的差异。未来研究若能确定网络层面上存储记忆表征的重新激活,或这些表征在大脑区域之间的转移是否对这种相关性有所贡献,将具有重要意义。
另一个挑战在于如何运用创新策略来验证间隔效应认知理论的预测。以缺陷加工理论的一个变体为例,该理论认为记忆的巩固需要进行多次认知排练。从神经层面看,这种排练很可能表现为特定神经元组合的重复激活,这些神经元组合作为长期记忆痕迹的存储位置。那么,从实证角度来看,这种重复激活对于维持记忆数天或更长时间是否确实必要?研究表明,神经元组合的自发重复激活确实存在,而且编码近期经历的神经元组合也会进行重复回放或排练
。一项支持回放必要性的研究发现,当抑制杏仁核中那些经过基因工程改造而过度表达 CREB 的神经元在训练后的活动时,会阻断可卡因与特定位置之间关联记忆的巩固过程
。同样,不分选择地激活那些过度表达 CREB 的神经元也产生了类似的阻断效果。尽管这些结果令人鼓舞,但这些操作尚缺乏细胞层面的精确度,无法确切证明特定神经元组合的重新激活对长期记忆的持久性至关重要。未来采用光遗传学技术的研究有望提供这种精确度。同样,我们还需要创新策略来探究有效的间隔学习是否需要在神经元网络层面上整合情境和情节记忆(如编码变异性理论所假设的),或者是否需要因更大的提取努力而增强记忆整合(如学习阶段提取理论所假设的)。
要成功预测能够克服人类学习缺陷的行为训练方案的间隔结构(无论是单独应用还是与药物治疗结合),我们需要更深入地了解支持长时程增强(LTP)和长期记忆形成的信号通路,以及了解这些缺陷如何影响这些通路。由于知识尚存在空白,未来的模型可能仍不完善。例如,数据往往不完整,且生化参数(如酶活性或蛋白质浓度)的值不可避免地存在不确定性。在模型开发过程中,通常需要利用来自不同实验准备类型(例如细胞培养和组织切片)和不同物种(如灵长类和啮齿类动物)的数据来估计各种参数。尽管这些局限性确实重要,但正如本综述所讨论的,将模型构建与实验相结合的方法潜在益处广泛,这一策略有望改善学习和记忆障碍患者的临床和教育效果。此外,这种策略也可能有助于提升没有这类缺陷的个体的教育和学习效果。事实上,通过合理的药物治疗来增强正常学习能力最近已引起关注
,而将药物与优化的间隔学习方案相结合可能会产生更加理想的成果。
参考文献
- Ebbinghaus, H. Memory; a Contribution to Experimental Psychology Ch. 2 (Teachers College, Columbia University, 1913).
- Cepeda, N. J., Pashler, H., Vul, E., Wixted, J. T. & Rohrer, D. Distributed practice in verbal recall tasks: a review and quantitative synthesis. Psychol. Bull. 132, 354-380 (2006).
This extensive review and meta-analysis delineates the comprehensive body of knowledge describing human spaced and massed verbal learning, as well as theories posited to explain the superiority of spaced training over massed training in terms of inducing long-term memory formation. - Godbole, N. R., Delaney, P. F. & Verkoeijen, P. P. The spacing effect in immediate and delayed free recall. Memory 22, 462-469 (2014).
- Raman, M. et al. Teaching in small portions dispersed over time enhances long-term knowledge retention. Med. Teach. 32, 250-255 (2010).
- Donovan, J. J. & Radosevich, D. J. A meta-analytic review of the distribution of practice effect. J. Appl. Psychol. 84, 795-805 (1999).
- Shea, C. H., Lai, Q., Black, C. & Park, J. H. Spacing practice sessions across days benefits the learning of motor skills. Hum. Mov. Sci. 19, 737-760 (2000).
- Gluckman, M., Vlach, H. A. & Sandhofer, C. M. Spacing simultaneously promotes multiple forms of learning in children's science curriculum. Appl. Cognit. Psychol. 28, 266-273 (2014).
- McDaniel, M. A. & Callender, A. A. in Learning and Memory: A Comprehensive Reference Vol. 2 (ed. Roediger, H. L.) 819–844 (Academic Press, 2008).
- Sobel, H. S., Cepeda, N. J. & Kapler, I. V. Spacing effects in real-world classroom vocabulary learning. Appl. Cognit. Psychol. 25, 763-767 (2011).
- Vlach, H. A. The spacing effect in children's generalization of knowledge: allowing children time to forget promotes their ability to learn. Child Dev. Persp. 8, 163-168 (2014).
This study found that, in children's education, spacing of learning sessions promoted not only better fact retention but also generalization of currently learned items to bind with and extend previously established conceptual categories. - Philips, G. T., Kopec, A. M. & Carew, T. J. Pattern and predictability in memory formation: from molecular mechanisms to clinical relevance. Neurobiol. Learn. Mem. 105, 117-124 (2013).
- Philips, G. T., Ye, X., Kopec, A. M. & Carew, T. J. MAPK establishes a molecular context that defines effective training patterns for long-term memory formation. J. Neurosci. 33, 7565-7573 (2013).
This work characterized the dynamics of MAPK and its activation of ,a transcription factor that is important for long-term memory formation, identifying the response of MAPK within a specific time window as essential for generating an optimal inter-trial interval. - Wainwright, M. L., Zhang, H., Byrne, J. H. & Cleary, L. J. Localized neuronal outgrowth induced by long-term sensitization training in Aplysia. J. Neurosci. 22, 4132-4141 (2002).
- Mauelshagen, J., Sherff, C. M. & Carew, T. J. Differential induction of long-term synaptic facilitation by spaced and massed applications of serotonin at sensory neuron synapses of Aplysia californica. Learn. Mem. 5, 246-256 (1998).
- Beck, C. D., Schroeder, B. & Davis, R. L. Learning performance of normal and mutant Drosophila after repeated conditioning trials with discrete stimuli. J. Neurosci. 20, 2944-2953 (2000).
- Pagani, M. R., Oishi, K., Gelb, B. D. & Zhong, Y. The phosphatase SHP2 regulates the spacing effect for long-term memory induction. Cell 139, 186-198 (2009).
- Menzel, R., Manz, G., Menzel, R. & Greggers, U. Massed and spaced learning in honeybees: the role of CS, US, the intertrial interval, and the test interval. Learn. Mem. 8, 198-208 (2001).
- Anderson, M. J., Jablonski, S. A. & Klimas, D. B. Spaced initial stimulus familiarization enhances novelty preference in Long-Evans rats. Behav. Processes 78, 481-486 (2008).
- Bello-Medina, P. C., Sanchez-Carrasco, L., Gonzalez-Ornelas, N. R., Jeffery, K. J. & Ramirez-Amaya, V. Differential effects of spaced versus massed training in long-term object-identity and object-location recognition memory. Behav. Brain Res. 250, 102-113 (2013).
- Medin, D. L. The comparative study of memory. J. Hum. Evol. 3, 455–463 (1974).
- Robbins, O. & Bush, C. T. Memory in great apes. J. Exp. Psychol. 97, 344–348 (1973).
- Urcelay, G. P., Wheeler, D. S. & Miller, R. R. Spacing extinction trials alleviates renewal and spontaneous recovery. Learn. Behav. 37, 60-73 (2009).
- Benjamin, A. S. & Tullis, J. What makes distributed practice effective? Cogn. Psychol. 61, 228-247 (2010).
- Madigan, S. A. Intraserial repetition and coding processes in free recall. J. Verb. Learn. Verb. Behav. 8, 828-835 (1969).
- Melton, A. W. The situation with respect to the spacing of repetitions and memory. J. Verb. Learn. Verb. Behav. 9, 596-606 (1970).
- Braun, K. & Rubin, D. C. The spacing effect depends on an encoding deficit, retrieval, and time in working memory: evidence from once-presented words. Memory 6, 37-65 (1998).
- Greene, R. L. Spacing effects in memory: evidence for a two-process account. J. Exp. Psychol. Learn. Mem. Cogn. 15, 371-377 (1989).
- Hintzman, D. L., Summers, J. J. & Block, R. A. Spacing judgments as an index of study-phase retrieval. J. Exp. Psychol. Hum. Learn. 1, 31-40 (1975).
- Tzeng, O. J. & Cotton, B. A study-phase retrieval model of temporal coding. J. Exp. Psychol. Hum. Learn. 6, 705-716 (1980).
- Siegel, L. L. & Kahana, M. J. A retrieved context account of spacing and repetition effects in free recall. J. Exp. Psychol. Learn. Mem. Cogn. 40, 755-764 (2014).
- Hintzman, D. L. in Theories in Cognitive Psychology: The Loyola Symposium (ed. Solso, R. L.) 77-90 (Erlbaum, 1974).
- Dempster, F. N. Spacing effects and their implications for theory and practice. Educ. Psychol. Rev. 1, 309-330 (1989).
- Toppino, T. C. The spacing effect in young children's free recall: support for automatic-process explanations. Mem. Cognit. 19, 159-167 (1991).
- Hintzman, D. L. in The Psychology of Learning and Motivation Vol. 10 (ed. Bower, G. H.) 47-91 (Academic Press, 1976).
- Rundus, D. Analysis of rehearsal processes in free recall. J. Exp. Psychol. 89, 63-77 (1971).
- Lechner, H. A., Squire, L. R. & Byrne, J. H. 100 years of consolidation - remembering Müller and Pilzecker. Learn. Mem. 6, 77-87 (1999).
- Landauer, T. K. Reinforcement as consolidation. Psychol. Rev. 76, 82-96 (1969).
This early paper posited and described elements of the dynamics of spaced learning, such as the saturation of memory formation by closely spaced trials and the failure of reinforcement for long trial spacing, and how these elements generate an optimal inter-trial interval. - Peterson, L. R. Short-term verbal memory and learning. Psychol. Rev. 73, 193-207 (1966).
- Wickelgren, W. A. Trace resistance and the decay of long-term memory. J. Math. Psychol. 9, 418-455
- Cuddy, L. J. & Jacoby, L. J. When forgetting helps memory: an analysis of repetition effects. J. Verb. Learn. Verb. Behav. 21, 451-467 (1982).
- Toppino, T. C. & Bloom, L. C. The spacing effect, free recall, and two-process theory: a closer look. J. Exp. Psychol. Learn. Mem. Cogn. 28, 437-444 (2002).
- Nabavi, S. et al. Engineering a memory with LTD and LTP. Nature 511, 348-352 (2014).
- Bosch, M. & Hayashi, Y. Structural plasticity of dendritic spines. Curr. Opin. Neurobiol. 22, 383-388 (2012).
- Bell, M. E. et al. Dynamics of nascent and active zone ultrastructure as synapses enlarge during LTP in mature hippocampus. J. Comp. Neurol. 522, 3861-3864 (2014).
This work, one of a group of related studies by the Harris laboratory, characterized in detail pre- and postsynaptic structural changes that are necessary for the consolidation of LTP. - Bourne, J. N. & Harris, K. M. Coordination of size and number of excitatory and inhibitory synapses results in a balanced structural plasticity along mature hippocampal CA1 dendrites during LTP. Hippocampus 21, 354-373 (2011).
- Cao, G. & Harris, K. M. Augmenting saturated LTP by broadly spaced episodes of theta-burst stimulation in hippocampal area CA1 of adult rats and mice. J. Neurophysiol. 112, 1916-1924 (2014).
- Kramár, E. A. et al. Synaptic evidence for the efficacy of spaced learning. Proc. Natl Acad. Sci. USA 109, 5121-5126 (2012).
This study, together with reference 48, substantiates the key hypothesis that spaced stimuli first prime and then strengthen upon repetition successive groups of dendritic spines, creating a morphological correlate of the memory trace that spaced, but not massed, protocols effectively consolidate. - Lynch, G., Kramár, E. A., Babayan, A. H., Rumbaugh, G. & Gall, C. M. Differences between synaptic plasticity thresholds result in new timing rules for maximizing long-term potentiation. Neuropharmacology 64, 27-38 (2013).
- Rex, C. S. et al. Different Rho GTPase-dependent signaling pathways initiate sequential steps in the consolidation of long-term potentiation. J. Cell Biol. 186, 85-97 (2009).
- Nguyen, P. V., Abel, T. & Kandel, E. R. Requirement of a critical period of transcription for induction of a late phase of LTP. Science 265, 1104-1107 (1994).
- Scharf, M. T. et al. Protein synthesis is required for the enhancement of long-term potentiation and long-term memory by spaced training. J. Neurophysiol. 87, 2770-2777 (2002).
- Kandel, E. R. The molecular biology of memory storage: a dialogue between genes and synapses. Science 294, 1249–1254 (2001).
- Silva, A. J., Kogan, J. H., Frankland, P. W. & Kida, S. CREB and memory. Annu. Rev. Neurosci. 21, 127-148 (1998).
- Liu, R. Y., Fioravante, D., Shah, S. & Byrne, J. H. cAMP response element-binding protein 1 feedback loop is necessary for consolidation of long-term synaptic facilitation in Aplysia. J. Neurosci. 28, 1970-1976 (2008).
- Liu, R. Y., Cleary, L. J. & Byrne, J. H. The requirement for enhanced CREB 1 expression in consolidation of long-term synaptic facilitation and long-term excitability in sensory neurons of Aplysia. J. Neurosci. 31, 6871-6879 (2011).
- Liu, R. Y., Shah, S., Cleary, L. J. & Byrne, J. H. Serotonin- and training-induced dynamic regulation of CREB2 in Aplysia. Learn. Mem. 18, 245-249 (2011).
- Frost, W. N., Castellucci, V., Hawkins, R. D. & Kandel, E. R. Monosynaptic connections made by the sensory neurons of the gill- and siphon-withdrawal reflex in Aplysia participate in the storage of long-term memory for sensitization. Proc. Natl Acad. Sci. USA 82, 8266-8269 (1985).
- Pinsker, H. M., Hening, W. A., Carew, T. J. & Kandel, E. R. Long-term sensitization of a defensive withdrawal reflex in Aplysia. Science 182, 1039-1042 (1973).
- Beckinschtein, P. et al. Persistence of long-term memory storage requires a late protein synthesis- and BDNF-dependent phase in the hippocampus. Neuron 53, 261-277 (2007).
- Bambah-Mukku, D., Travaglia, A., Chen, D. Y., Pollonini, G. & Alberini, C. M. A positive autoregulatory BDNF feedback loop via C/EBPβ mediates hippocampal memory consolidation. J. Neurosci. 34, 12547-12559 (2014). This study characterizes the dynamics of a molecular positive feedback loop demonstrated to be important for the consolidation of long-term (24 hours or more) memory, as well as the late repression of that terminates the feedback.
- Genoux, D. et al. Protein phosphatase 1 is a molecular constraint on learning and memory. Nature 418, 970–974 (2002).
- Farah, C. A., Weatherill, D., Dunn, T. W. & Sossin, W. S. PKC differentially translocates during spaced and massed training in Aplysia. J. Neurosci. 29, 10281-10286 (2009).
- Tully, T., Preat, T., Boynton, S. & Del Vecchio, M. Genetic dissection of consolidated memory in Drosophila melanogaster. Cell 79, 35-47 (1994).
- Yin, J. C., Del Vecchio, M., Zhou, H. & Tully, T. CREB as a memory modulator: induced expression of a dCREB2 activator isoform enhances long-term memory in Drosophila. Cell 81, 107-115 (1995).
- Smolen, P., Baxter, D. A. & Byrne, J. H. Frequency selectivity, multistability, and oscillations emerge from models of genetic regulatory systems. Am. J. Physiol. 274, C531-C542 (1998).
- Philips, G. T., Tzvetkova, E. I. & Carew, T. J. Transient mitogen-activated protein kinase activation is confined to a narrow temporal window required for the induction of two-trial long term memory in Aplysia. J. Neurosci. 27, 13701-13705 (2007).
- Seese, R. R., Wang, K., Yao, Y. Q., Lynch, G. & Gall, C. M. Spaced training rescues memory and ERK1/2 signaling in fragile X syndrome model mice. Proc. Natl Acad. Sci. USA 111, 16907-16912 (2014).
- Rosenblum, K. et al. The role of extracellular regulated kinases I/II in late-phase long-term potentiation. J. Neurosci. 22, 5432-5441 (2002).
- Ajay, S. M. & Bhalla, U. S. A propagating ERKII switch forms zones of elevated dendritic activation correlated with plasticity. HFSP J. 1, 49-66 (2007).
- Chen, C. et al. Visualizing long-term memory formation in two neurons of the Drosophila brain. Science 335, 678-685 (2012).
- Cepeda, N. J. et al. Optimizing distributed practice: theoretical analysis and practical implications. Exp. Psychol. 56, 236-246 (2009).
- Wei, Y. & Koulakov, A. A. Long-term memory stabilized by noise-induced rehearsal. J. Neurosci. 34, 15804-15815 (2014).
- Cui, Z. et al. Inducible and reversible NR1 knockout reveals a crucial role of the NMDA receptor in preserving remote memories in the brain. Neuron 41, 781-793 (2004).
This study demonstrates the key point that ongoing neural activity and NMDA receptor activation are essential for long-lasting preservation of stored memory - Tetzlaff, C., Kolodziejski, C., Timme, M., Tsodyks, M. & Worgotter, F. Synaptic scaling enables dynamically distinct short- and long-term memory formation. PLoS Comput. Biol. 9, e1003307 (2013).
- Miller, P., Zhabotinsky, A. M., Lisman, J. E. & Wang, X. J. The stability of a stochastic CaMKII switch: dependence on the number of enzyme molecules and protein turnover. PLoS Biol. 3, e107 (2005).
- Pettigrew, D. B., Smolen, P., Baxter, D. A. & Byrne, J. H. Dynamic properties of regulatory motifs associated with induction of three temporal domains of memory in Aplysia. J. Comput. Neurosci. 18, 163-181 (2005).
- Shema, R., Sacktor, T. C. & Dudai, Y. Rapid erasure of long-term memory associations in the cortex by an inhibitor of PKMζ. Science 317, 951-953 (2007).
- Volk, L. J., Bachman, J. L., Johnson, R., Yu, Y. & Huganir,R. L. PKM- is not required for hippocampal synaptic plasticity, learning and memory. Nature 493, 420-423 (2013).
- Fioriti, L. et al. The persistence of hippocampal-based memory requires protein synthesis mediated by the prion-like protein CPEB3. Neuron 86, 1433-1448 (2015).
- Ajay, S. M. & Bhalla, U. S. A role for ERKII in synaptic pattern selectivity on the time scale of minutes. Eur. J. Neurosci. 20, 2671-2680 (2004).
- Frey, U. & Morris, R. G. Synaptic tagging: implications for late maintenance of hippocampal long-term potentiation. Trends Neurosci. 21, 181-188 (1998).
- Babayan, A. H. et al. Integrin dynamics produce a delayed stage of long-term potentiation and memory consolidation. J. Neurosci. 32, 12854-12861 (2012).
- Callan, D. E. & Schweighofer, N. Neural correlates of the spacing effect in explicit verbal semantic encoding support the deficient-processing theory. Hum. Brain Mapp. 31, 645-659 (2010).
- Karpicke, J. D. & Roediger, H. L. Is expanding retrieval a superior method for learning text materials? Mem. Cognit. 38, 116-124 (2010).
- Zhang, Y. et al. Computational design of enhanced learning protocols. Nat. Neurosci. 15, 294-297
This study found that computational models describing long-term synaptic strengthening can successfully predict optimal spaced training protocols, with irregular inter-trial intervals, that enhance learning. - Bhalla, U. S. & Iyengar, R. Emergent properties of networks of biological signaling pathways. Science 283, 381-387 (1999).
- Kim, M., Huang, T., Abel, T. & Blackwell, K. T. Temporal sensitivity of protein kinase A activation in late-phase long term potentiation. PLoS Comput. Biol. 6, e1000691 (2010).
- Smolen, P., Baxter, D. A. & Byrne, J. H. A model of the roles of essential kinases in the induction and expression of late long-term potentiation. Biophys. J. 90, 2760-2775 (2006).
- Aslam, N. & Shouval, H. Z. Regulation of cytoplasmic polyadenylation can generate a bistable switch. BMC Syst. Biol. 6, 12-20 (2012).
- Liu, R. Y. et al. Deficit in long-term synaptic plasticity is rescued by a computationally predicted stimulus protocol. J. Neurosci. 33, 6944-6949 (2013).
- Montarolo, P. G. et al. A critical period for macromolecular synthesis in long-term heterosynaptic facilitation in Aplysia. Science 234, 1249-1254 (1986).
- Müller, U. & Carew, T. J. Serotonin induces temporally and mechanistically distinct phases of persistent PKA activity in Aplysia sensory neurons. Neuron 21, 1423-1434 (1998).
- Korzus, E., Rosenfeld, M. G. & Mayford, M. CBP histone acetyltransferase activity is a critical component of memory consolidation. Neuron 42, 961-972 (2004).
- Park, E. et al. Epigenetic mechanisms of Rubinstein-Taybi syndrome. Neuromolecular Med. 16, 16-24 (2014).
- Alarcon, J. M. et al. Chromatin acetylation, memory, and LTP are impaired in mice: a model for the cognitive deficit in Rubinstein-Taybi syndrome and its amelioration. Neuron 42, 947-959 (2004).
- Alberini, C. M. Transcription factors in long-term memory and synaptic plasticity. Physiol. Rev. 89, 121-145 (2009).
- Zhou, L. et al. Rescue of impaired long-term facilitation at sensorimotor synapses of Aplysia following siRNA knockdown of CREB1. J. Neurosci. 35, 1617-1626 (2015).
- Abel, T. & Nguyen, P. V. Regulation of hippocampus-dependent memory by cyclic AMP-dependent protein kinase. Prog. Brain Res. 169, 97-115 (2008).
- Bartsch, D., Casadio, A., Karl, K. A., Serodio, P. & Kandel, E. R. CREB1 encodes a nuclear activator, a repressor, and a cytoplasmic modulator that form a regulatory unit critical for long-term facilitation. Cell 95, 211–223 (1998).
- Kida, S. A functional role for CREB as a positive regulator of memory formation and LTP. Exp. Neurobiol. 21, 136–140 (2012).
- Bartsch, D. et al. Aplysia CREB2 represses long-term facilitation: relief of repression converts transient facilitation into long-term functional and structural change. Cell 83, 979-992 (1995).
- Dong, C., Upadhya, S. C., Ding, L., Smith, T. K. & Hegde, A. N. Proteosome inhibition enhances the induction and impairs the maintenance of late-phase long-term potentiation. Learn. Mem. 15, 335-347 (2008).
- Pasini, S., Corona, C., Liu, J., Greene, L. A. & Shelanski, M. L. Specific downregulation of hippocampal ATF4 reveals a necessary role in synaptic plasticity and memory. Cell Rep. 11, 183-191 (2015).
- Smolen, P., Baxter, D. A. & Byrne, J. H. Simulations suggest pharmacological methods for rescuing long-term potentiation. J. Theor. Biol. 360, 243-250 (2014).
- Cuadrado-Tejedor, M. et al. Concomitant histone deacetylase and phosphodiesterase 5 inhibition synergistically prevents the disruption in synaptic plasticity and it reverses cognitive impairment in a mouse model of Alzheimer's disease. Clin. Epigenetics 7, 108 (2015).
- Ikegaya, Y. et al. Synfire chains and cortical songs: temporal modules of cortical activity. Science 304, 559-564 (2004).
- Miller, J. E., Ayzenshtat, I., Carrillo-Reid, L. & Yuste, R. Visual stimuli recruit intrinsically generated cortical ensembles. Proc. Natl Acad. Sci. USA 111, E4053-E4061 (2014).
- Karlsson, M. P. & Frank, L. M. Awake replay of remote experiences in the hippocampus. Nat. Neurosci. 12, 913-919 (2009).
- Wu, X. & Foster, D. J. Hippocampal replay captures the unique topological structure of a novel environment. J. Neurosci. 34, 6459-6469 (2014).
- Hsiang, H. L. et al. Manipulating a "cocaine engram" in mice. J. Neurosci. 34, 14115-14127 (2014).
- Lynch, G., Cox, C. D. & Gall, C. M. Pharmacological enhancement of memory or cognition in normal subjects. Front. Syst. Neurosci. 8, 90 (2014).
Acknowledgements
This work was supported by US National Institutes of Health grants NS073974 and NS019895.
Competing interests statement
The authors declare no competing interests.
Thoughts Memo 汉化组译制
感谢主要译者 claude-3.7-sonnet,校对 Jarrett Ye
原文:The right time to learn: mechanisms and optimization of spaced learning | Nature Reviews Neuroscience
